La idea de hablar de hierro y úlcera venosa me ha surgido al leer un artículo que se acaba de publicar sobre la potencial relación entre el déficit de hierro y la úlcera venosa, sugiriendo el posible papel de la papel de la pérdida de hierro por el exudado de la herida: “Does localized iron loss in venous disease lead to systemic iron deficiency? A descriptive pilot study”1. Además, los autores de este trabajo también acaban de publicar una revisión sobre los depósitos de hierro, la anemia y la úlcera venosa: “An overview of the relationship between anaemia, iron, and venous leg ulcers”2
Dado que todavía queda mucho por investigar sobre la relación déficit de hierro-úlcera venosa y el impacto real de la anemia en la cicatrización, vamos a hablar de algo sobre lo que hay algún estudio más, aunque la evidencia disponible sea también poco robusta: El papel de los depósitos de hierro locales en la evolución de la insuficiencia venosa crónica.
¿Qué funciones tiene el hierro en el organismo?
El hierro es el oligoelemento más abundante en nuestro organismo y tiene un papel fundamental en muchas funciones celulares. Es una parte esencial de la hemoglobina ya que facilita el transporte de oxígeno a los tejidos. Participa en múltiples procesos metabólicos, ya que forma parte de enzimas y otros complejos moleculares. Además, también tiene una función importante en tejidos con mucho recambio celular, como la piel, ya que regula la replicación del ADN.
A pesar de ser un metal fundamental para la vida, en cantidades elevadas puede resultar tóxico. Esto es debido a que el hierro libre tiene la capacidad de ceder o donar electrones con facilidad (paso cíclico del estado Fe2+ a Fe3+) y puede catalizar reacciones vía radicales libres e incrementar el estrés oxidativo.
Nuestro organismo se encarga de limitar este potencial daño mediante el almacenamiento del hierro en complejos proteicos, como la hemoglobina, transferrina o ferritina. Además, existen muchos mecanismos reguladores para mantener un adecuado balance entre el hierro libre (peligroso) y el ligado a proteínas. Sin embargo, estos mecanismos reguladores no son suficientes cuando hay una sobrecarga no controlada de hierro, tanto a nivel sistémico como local.
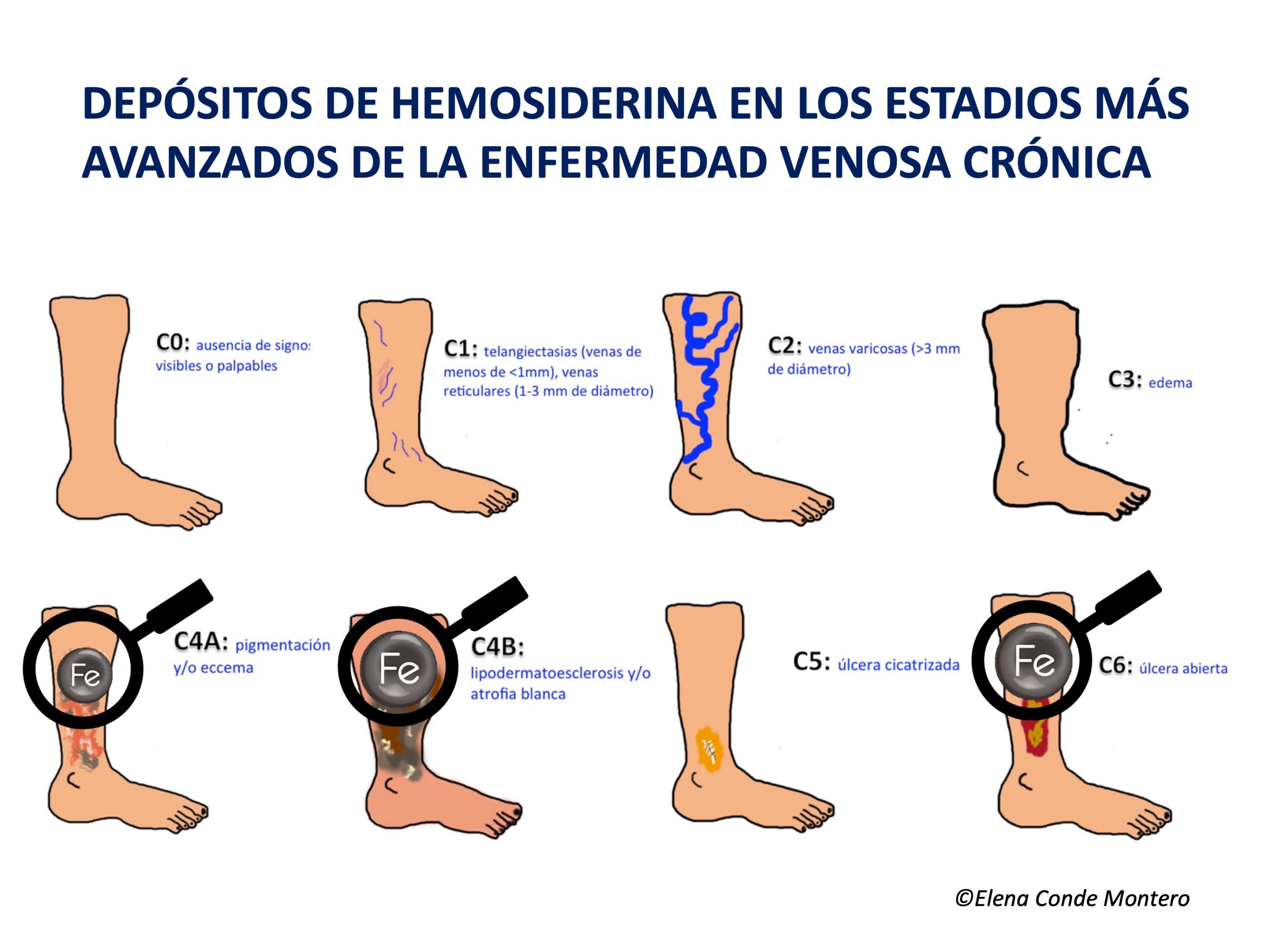
¿Por qué se producen los depósitos cutáneos de hierro en las piernas?
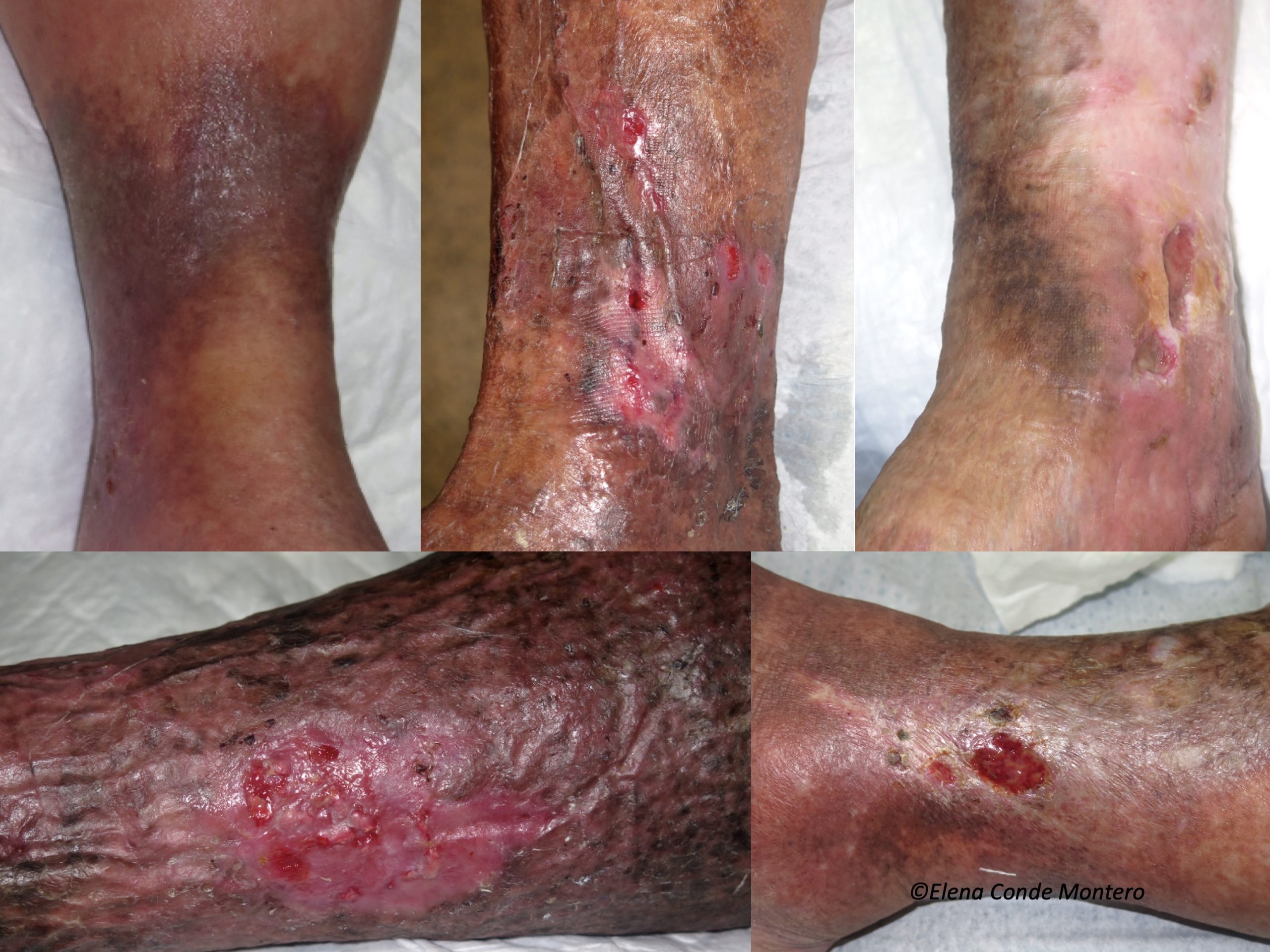
La hipertensión venosa no controlada, causante de la insuficiencia venosa crónica (IVC), hace que se produzca una extravasación de eritrocitos hacia la piel. Estos glóbulos rojos extravasados son ingeridos y degradados por los macrófagos de la dermis, que liberan y almacenan el hierro en su interior, primero en forma de ferritina y, posteriormente, cuando se satura, en el complejo proteico denominado hemosiderina. Estos depósitos de hierro, además de los de melanina (los melanocitos se activan con los procesos inflamatorios que afectan a la piel, como la IVC), producen una coloración marronácea en la piel, que se denomina por ello dermatitis ocre y es una de las características clínicas del estadio C4 de la clasificación CEAP de la enfermedad venosa crónica (Ver post “Clasificación CEAP de los trastornos venosos crónicos: hablemos todos el mismo idioma”). ¿Qué peso tienen, por separado, la hemosiderina y la melanina en el color ocre de estas piernas? Pregunta difícil de contestar, ya que la hemosiderina activa la producción de melanina por los melanocitos…
El problema de esta hiperpigmentación no es solo estético, sino que ese hierro depositado en la piel parece tener gran importancia en la evolución de la enfermedad venosa y, por tanto, de la úlcera venosa. De hecho, en la consulta observamos que las úlceras en piernas con extensos depósitos de hemosiderina son más resistentes al tratamiento.
¿Qué se ha investigado sobre los depósitos de hemosiderina y la evolución de la enfermedad venosa?
Los trabajos publicados son escasos e incluyen pocos pacientes. El grupo de Caggiati realizó 2 estudios en los que se analizaron los depósitos de hemosiderina en biopsias cutáneas de piernas en diferentes estadios de enfermedad venosa crónica.3,4 En ambos estudios, la mayoría de pacientes con coloración cutánea normal no presentaron depósitos de hemosiderina en la biopsia (detectados mediante la tinción de Perls). En los pacientes con hiperpigmentación (C4), sólo se hallaron depósitos de hemosiderina en los que tenían mayor pigmentación. De hecho, en estadios iniciales, estos autores asocian la coloración marronácea con mayor cantidad de melanina, ya que, como hemos dicho, los melanocitos se pueden activar en todo proceso inflamatorio cutáneo. En estadios más avanzados, como lipodermatosclerosis (C4b) y úlcera venosa (C6) siempre se encontraron estos depósitos. No se incluyeron pacientes con úlceras cicatrizadas (C5), por lo que no se pueden extraer conclusiones de este grupo. Los autores concluyen que, a pesar de no poder sacar conclusiones fisiopatológicas, lo que sí está claro es que los cambios cutáneos evolutivos de la enfermedad venosa crónica se asocian con la presencia de depósitos de hemosiderina. También sugieren que pueda haber algún condicionante genético que justifique un mayor depósito de hierro (y también de melanina) en ciertos pacientes.
 Con respecto a los pocos estudios que comparan los niveles de hierro en el exudado de heridas crónicas vs agudas y en el borde vs tejido perilesional, destaca la variabilidad entre los métodos empleados para la detección. Sin embargo, los resultados apuntan a una mayor cantidad de hierro en el lecho de las úlceras crónicas y en el borde de la herida.
Con respecto a los pocos estudios que comparan los niveles de hierro en el exudado de heridas crónicas vs agudas y en el borde vs tejido perilesional, destaca la variabilidad entre los métodos empleados para la detección. Sin embargo, los resultados apuntan a una mayor cantidad de hierro en el lecho de las úlceras crónicas y en el borde de la herida.
¿Qué papel pueden tener los depósitos de hierro en la cronicidad de las heridas?
Como comentamos en el post “Herida crónica-inflamación crónica”, la diferenciación de los macrófagos y su paso del tipo M1 (proinflamatorio) al M2 (antiinflamatorio) es fundamental en la transición de la fase inflamatoria a la proliferativa del proceso de cicatrización. Pues bien, el hierro parece estar implicado en estos cambios ya que, al ser ingerido por los M1, mantiene su actividad y dificulta su transformación en M2.
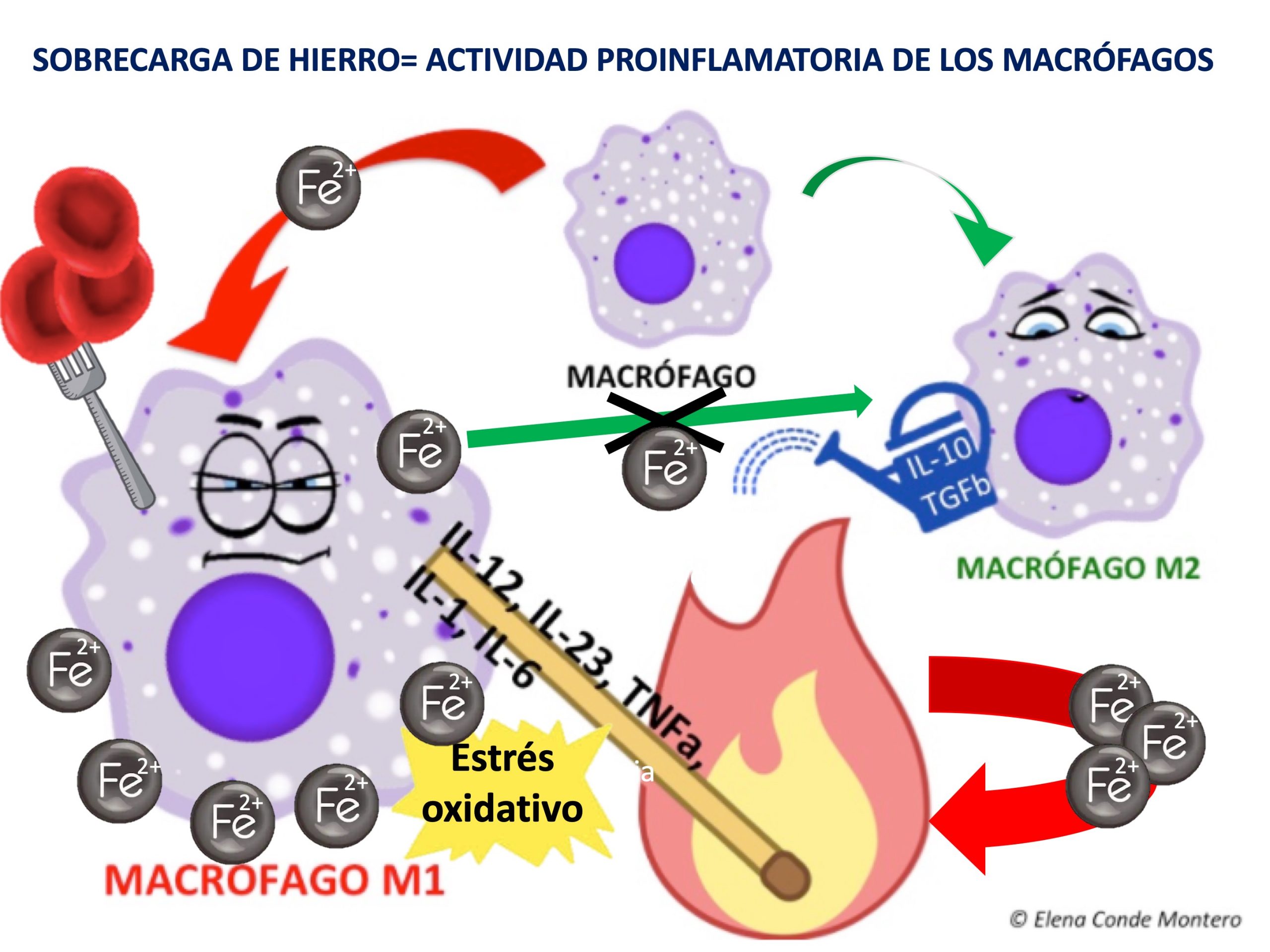
Es decir, los depósitos de hierro favorecen la persistencia de los macrófagos M1 y la consiguiente liberación de citoquinas proinflamatorias. Además, los radicales libres de oxígeno liberados por las reacciones químicas de los iones de hierro en los macrófagos hacen que se acumulen fibroblastos senescentes resistentes a la apoptosis, que también liberan factores proinflamatorios.5 Este microambiente proinflamatorio produce más extravasación hemática y, por tanto, más depósitos de hierro, produciéndose un círculo vicioso.
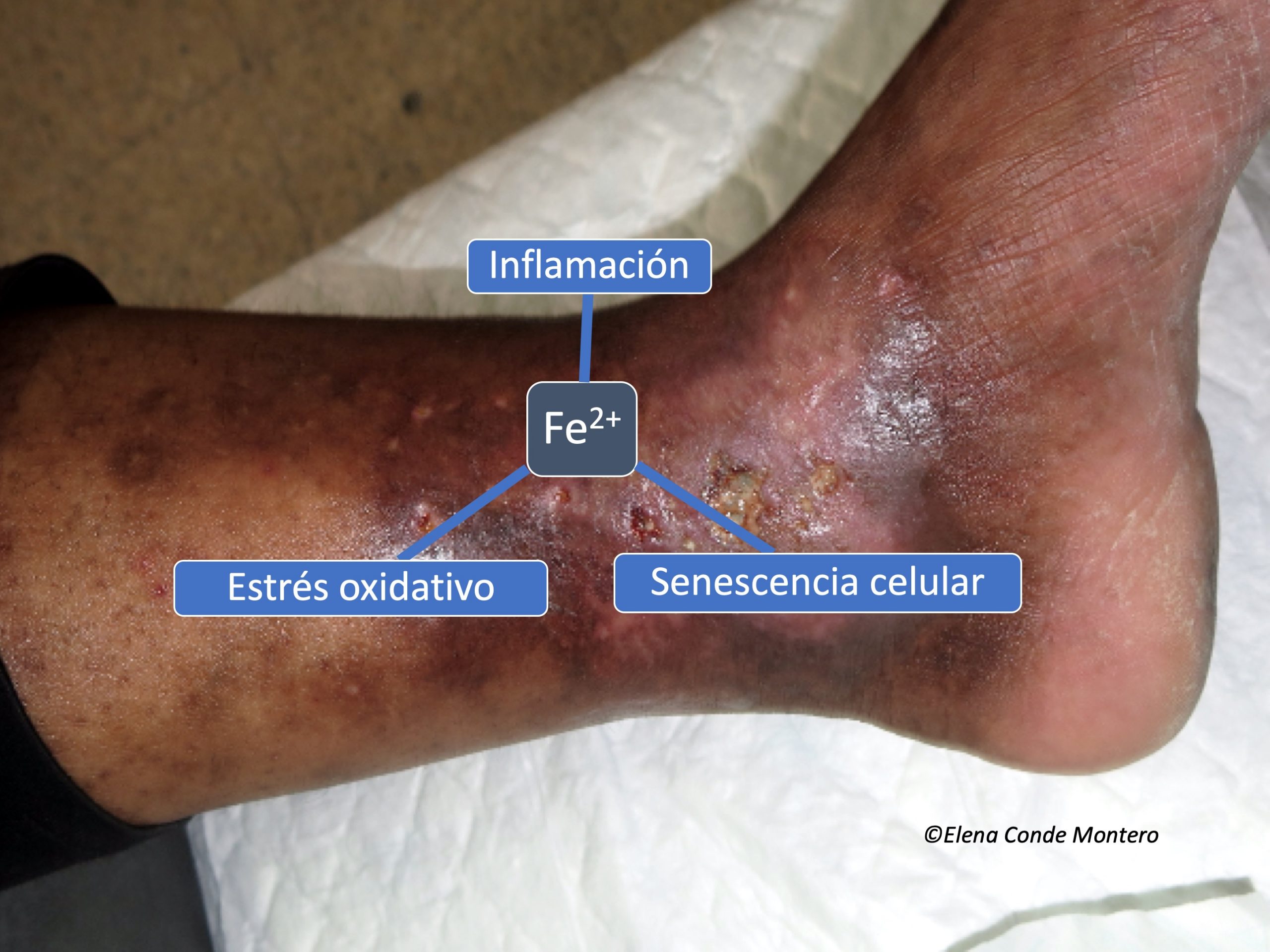
¿Qué se podría hacer para controlar la acción proinflamatoria de los depósitos de hierro?
Pues lo más razonable sería buscar un método de quelación (secuestro) de hierro dentro de la herida para evitar que el hierro iónico libere especies reactivas de oxígeno. La deferoxamina es un quelante de hierro ya establecido como tratamiento sistémico para situaciones de sobrecarga de hierro como la hemocromatosis.
¿Tendría utilidad un apósito impregnado en desferoxamina? Hace más de 15 años se publicaron puntuales estudios in vitro que apuntan al interés de este quelante aplicado de manera tópica…6,7Hmmm ¿Por qué no se ha continuado investigando en esta línea?
¡Ojalá se realicen nuevos estudios para poder conocer el papel real de estos depósitos de hierro en la cronicidad de las úlceras venosas y, por tanto, su potencial papel como diana terapéutica!
Referencias:
- Ferris AE, Harding KG. Does localized iron loss in venous disease lead to systemic iron deficiency? A descriptive pilot study. Wound Repair Regen. 2020 Jan;28(1):33-38.
- Ferris AE, Harding KG. An overview of the relationship between anaemia, iron, and venous leg ulcers. Int Wound J. 2019 Dec;16(6):1323-1329.
- Caggiati A, Rosi C, Casini A, et al. Skin iron deposition characterises lipodermatosclerosis and leg ulcer. Eur J Vasc Endovasc Surg. 2010;40(6):777-782.
- Caggiati A, Rosi C, Franceschini M, Innocenzi D. The nature of skin pigmentations in chronic venous insufficiency: a preliminary report. Eur J Vasc Endovasc Surg. 2008;35(1):111-118.
- Wlaschek M, Singh K, Sindrilaru A, Crisan D, Scharffetter-Kochanek K. Iron and iron-dependent reactive oxygen species in the regulation of macrophages and fibroblasts in non-healing chronic wounds. Free Radic Biol Med. 2019 Mar;133:262-275.
- Wenk J, Foitzik A, Achterberg V, et al. Selective pick-up of increased iron by deferoxamine-coupled cellulose abrogates the iron-driven induction of matrix-degrading metalloproteinase 1 and lipid peroxidation in human dermal fibroblasts in vitro: a new dressing concept. J Invest Dermatol. 2001;116(6):833-839.
- Taylor JE, Laity PR, Hicks J, et al. Extent of iron pick-up in deforoxamine-coupled polyurethane materials for therapy of chronic wounds. Biomaterials. 2005;26(30):6024-6033.
Also available in: English (Inglés)







dios quiera se realicen más estudios relacionados con este problema.. mi madre tiene mas de 40 años con una ulcera varicosa y su hemoglobina la mantiene baja… y nunca hasta ahora que leo este articulo habia comprendido el porque no ha logrado cicatrizar… ojala pudieran descubrir mas sobre este problema